Que sont les protéines ?
Les protéines sont des composés organiques qui, comme les glucides et les lipides, contiennent les éléments carbone (C), hydrogène (H) et oxygène (O), ainsi que de l'azote (N). Certaines protéines contiennent en outre du soufre (S). Les protéines déterminent dans une large mesure le fonctionnement et la structure du corps humain. Elles sont donc non seulement un matériau de construction indispensable pour les cellules humaines, mais elles participent également de différentes manières à de nombreux processus métaboliques.
Les éléments constitutifs des protéines sont les acides aminés. Selon le nombre d'acides aminés qui composent une protéine, on distingue les oligopeptides, qui contiennent moins de dix acides aminés, les polypeptides, qui se composent de 10 à 100 acides aminés, et les protéines, qui contiennent plus de 100 acides aminés. La succession des acides aminés nécessaires à la fabrication des protéines est enregistrée dans l'ADN. En théorie, il est donc possible de former un nombre infini de protéines, puisque les acides aminés peuvent être combinés et enchaînés à volonté. En revanche, l'être humain ne produit "que" 30 000 protéines, qui exercent une multitude de fonctions dans le corps.
Dans l'organisme humain, 20 acides aminés différents sont nécessaires pour la synthèse des protéines. Neuf d'entre eux sont essentiels. Les acides aminés essentiels ne peuvent donc pas être produits par le corps lui-même et doivent donc être apportés en quantité suffisante par l'alimentation. Parmi ces 9 acides aminés figurent les trois acides aminés dits à chaîne ramifiée, à savoir la valine, la leucine et l'isoleucine. Ces acides aminés à chaîne ramifiée sont également appelés BCAA. Quatre autres acides aminés sont conditionnellement essentiels, c'est-à-dire qu'ils ne peuvent pas être produits en quantité suffisante par le corps dans certaines conditions (par exemple chez les nourrissons, en cas d'effort physique important) et deviennent donc essentiels dans ces situations.
Acides aminés essentiels
- Valine
- Leucine
- Isoleucine
- Histidine
- Lysine
- Méthionine
- Phénylalanine
- Thréonine
- Tryptophane
Acides aminés essentiels sous condition
- Tyrosine
- Cystéine
- Glutamine
- Arginine
Présence des protéines
La viande, le poisson, le lait et les produits laitiers ainsi que les œufs sont des sources de protéines d'origine animale, tandis que les céréales et les produits à base de soja, les légumineuses et les noix sont des sources végétales. Les sources de protéines végétales sont moins importantes que les protéines animales en termes de valeur biologique (voir ci-dessous).
Digestion, absorption et dégradation des protéines
Les protéines sont digérées dans l'environnement acide de l'estomac par des enzymes produites par la paroi gastrique, qui servent à couper les chaînes de protéines en chaînes plus courtes. Les enzymes gastriques sont rapidement inactivées dans l'intestin grêle et les chaînes de protéines déjà raccourcies sont décomposées en acides aminés individuels par les enzymes du pancréas. À la fin de la digestion, les acides aminés sont absorbés dans les cellules intestinales à l'aide de transporteurs dans la paroi intestinale, d'où ils passent dans le sang et finalement dans le foie. Là, les acides aminés peuvent être assemblés en protéines et libérés à nouveau dans le sang afin de permettre leur utilisation par d'autres organes, comme les muscles.
Les protéines du corps sont constamment fabriquées et décomposées. L'ammoniaque se forme lorsque les acides aminés sont dégradés dans les cellules. Celui-ci est toxique pour le corps et doit donc être éliminé. C'est pourquoi l'ammoniac produit est transformé en urée à grand renfort d'énergie et éliminé dans l'urine via les reins. Contrairement à l'ammoniaque, l'urée est donc relativement non toxique et très soluble dans l'eau.
Si l'apport en protéines augmente, il se forme davantage d'urée qui, en raison de sa bonne solubilité dans l'eau, retient une grande quantité d'eau. On perd donc plus de liquide avec une plus grande quantité d'urée. Une alimentation riche en protéines et une consommation insuffisante de liquide sollicitent donc inutilement les reins.
Fonctions des protéines dans le corps
Les protéines sont présentes dans l'organisme humain en tant que composants de :
- des hormones (peptidiques ou protéiques)
- enzymes
- des protéines membranaires de la paroi cellulaire (par ex. des récepteurs ou des protéines de transport)
- Protéines de soutien et de structure (par ex. collagène, kératine ou élastine)
- Protéines contractiles (par ex. filaments d'actine et de myosine en tant qu'éléments contractiles du muscle)
- protéines plasmatiques (par ex. albumine)
- les protéines de transport (par ex. l'hémoglobine, la myoglobine et certaines protéines plasmatiques)
- Facteurs de coagulation du sang
- anticorps
- Pour l'approvisionnement en énergie, uniquement fonction de réserve
En ce qui concerne l'apport énergétique, les protéines n'ont une importance que dans des cas exceptionnels (par exemple en cas d'apport énergétique très faible ou d'effort d'endurance de plusieurs heures).
Les protéines ont la même valeur énergétique que les glucides (17 kJ/g (= 4 kcal/g)) et sont nettement inférieures à celles des graisses (39 kJ/g (=9 kcal/g)).
Besoin quotidien en protéines
Les besoins en protéines des sportifs, tant de force que d'endurance, sont plus élevés, environ 1,2-1,8 g/kg de poids corporel par jour. Si les besoins sont couverts, un apport en protéines encore plus élevé n'apporte aucun avantage. Cependant, un timing optimal de la prise permet de maximiser le taux de synthèse des protéines, ce qui a donc un effet positif sur l'adaptation aux stimuli de l'entraînement (p. ex. développement de la masse musculaire).
Qualité des protéines
Si l'on en croit les recommandations de la plupart des fabricants de compléments protéinés, tout ou presque entre dans la catégorie des "protéines de haute qualité". Malheureusement, d'un point de vue objectif, ce n'est pas le cas.
En ce qui concerne la valeur de différentes sources de protéines, il existe plusieurs "scores" utilisés dans la pratique. Outre la "valeur biologique" obsolète (et souvent indéfinie), c'est surtout le cas du "Protein Digestibility Corrected Amino Acid Score" (PDCAAS), qui devrait pourtant être remplacé systématiquement par le "Digestible indispensable amino acid score" (DIAAS), conformément aux recommandations de la "Food and Agriculture Organization of the United Nations" (FAO) et de la "World Health Organization" (WHO).
Celui-ci est défini comme suit : DIAAS (%) = 100 x [(quantité en mg d'un acide aminé indispensable digestible dans 1 g de protéine alimentaire) / (quantité en mg du même acide aminé indispensable digestible dans 1 g de protéine de référence)], où la digestibilité fait référence à la digestibilité dans l'intestin grêle (évaluation la plus précise de la digestibilité). Le DIAAS évalue donc la capacité d'une protéine à couvrir les besoins du métabolisme humain.
Pour simplifier, on peut dire ce qui suit à propos du DIAAS :
- La qualité d'une source de protéines correspond en fin de compte à la "livraison" des acides aminés indispensables à l'organisme.
- La qualité de la source de protéines se compose de la disponibilité biologique, du profil d'acides aminés (répartition) et de la quantité d'acides aminés indispensables.
- Les DIAAS peuvent être supérieurs à 100%. Les protéines du lait (fraction totale) ont un DIAAS de 122%.
- Les aliments de mauvaise qualité atteignent, grâce à l'enrichissement par des sources de protéines de haute qualité ou éventuellement des acides aminés libres, des DIAAS plus élevés qu'à l'état non enrichi et peuvent ainsi être optimisés.
Qu'est-ce que cela signifie en termes de suppléments ?
Eh bien, il est clair en tout cas que de nombreux suppléments protéiques présentés comme étant de "haute qualité" (par exemple, les protéines végétales pures sans ajout d'acides aminés essentiels ; les hydrolysats de collagène, etc.) ne sont pas optimaux en ce qui concerne le métabolisme humain. En outre, nous pouvons constater que les suppléments protéiques à base de protéines de lait présentent des DIAAS élevés et sont donc de haute qualité. Cependant, si nous allons un peu plus loin dans les analyses scientifiques et que nous considérons les effets directs de l'apport de sources de protéines sur la synthèse et la dégradation des protéines, nous pouvons spécifier davantage les avantages des suppléments.
Mauvaise alimentation en protéines
Si l'apport en protéines est insuffisant, les performances physiques et intellectuelles diminuent. En outre, la fertilité et le système immunitaire sont affectés, ce qui entraîne une plus grande vulnérabilité aux maladies infectieuses. Une accélération des processus de vieillissement dans le corps peut également se produire dans le cadre d'une carence en protéines. En cas de carence massive en protéines, des œdèmes prononcés, c'est-à-dire des dépôts de liquide dans les tissus, peuvent se produire.
Un apport très élevé en protéines (>2,0 g/kg de poids corporel par jour) entraîne une sollicitation croissante des reins et du foie en raison de la formation accrue d'urée. Toutefois, cela ne pose pas de problème pour les organes en bonne santé.
Bilan protéique
Tous les tissus de notre corps sont composés en grande partie de protéines. Celles-ci (et donc aussi nos tissus, comme la musculature, la peau, les cheveux, le tissu conjonctif, etc.) sont soumises en permanence à des processus de construction et de dégradation, de sorte que notre corps doit sans cesse être approvisionné en matériaux de construction frais. Les matériaux de construction nécessaires à la construction des tissus sont appelés acides aminés, que notre corps extrait des protéines alimentaires lors de la digestion. En consommant des protéines alimentaires, nous fournissons donc essentiellement à notre corps les éléments nécessaires à la construction des tissus.
Le rapport entre l'accumulation et la dégradation des protéines corporelles s'appelle le bilan protéique. Les modifications de l'assimilation et de la dégradation des protéines sont déclenchées aussi bien par l'entraînement que par l'alimentation. Ces modifications ont pour effet d'augmenter ou de réduire le bilan protéique en très peu de temps en fonction des mesures d'entraînement et/ou d'alimentation et, au final, d'augmenter (bilan protéique positif) ou de diminuer (bilan protéique négatif) la masse protéique nette. Par exemple, la musculation sans apport alimentaire entraîne certes une augmentation de la synthèse des protéines (la construction de protéines), mais en raison de l'augmentation simultanée de la dégradation des protéines, elle conduit à un bilan protéique négatif (donc à une diminution nette des protéines corporelles).
Comment les protéines alimentaires influencent-elles le bilan protéique ?
L'exemple ci-dessus montre que même si un stimulus d'entraînement spécifique augmente la synthèse des protéines, cela ne se traduit pas par un bilan protéique positif aigu en l'absence de protéines alimentaires et ne conduit donc pas à une augmentation de la masse musculaire.
Cependant, si vous complétez votre entraînement de musculation par la prise de protéines alimentaires de haute qualité en quantité nécessaire, vous obtiendrez rapidement un bilan protéique positif. En effet, les protéines alimentaires supplémentaires stimulent la synthèse des protéines qui, en fin de compte, l'emporte sur la dégradation des protéines. Par conséquent, le corps accumule de très petites quantités de protéines. La somme de ces "surplus de construction de protéines", extrêmement petits en termes de quantité, entraîne à long terme une augmentation mesurable de la masse musculaire.
Qu'est-ce qui est responsable de l'augmentation de la synthèse des protéines ?
Certains acides aminés (essentiels) sont responsables de l'augmentation de la synthèse des protéines par les protéines alimentaires. Étant donné que les différentes sources de protéines contiennent ces acides aminés en quantités variables et dans des compositions différentes, les différentes sources de protéines ont une influence différente sur la synthèse des protéines musculaires. Nous y reviendrons dans un prochain article.
Outre la source de protéines, la quantité de protéines alimentaires consommées joue un rôle central dans l'augmentation du bilan protéique. Étant donné que la synthèse des protéines musculaires ne peut pas être augmentée à volonté et que, parallèlement, des quantités trop élevées de protéines totales stimulent la dégradation des protéines, l'apport efficace de protéines est soumis à des limites biologiques maximales. Il est donc inutile de consommer des quantités de protéines trop faibles ou trop élevées pour augmenter la synthèse des protéines musculaires.
Apport en protéines pendant la journée
Un apport complémentaire en protéines pendant la journée (par exemple en cas de besoins accrus en protéines dus à l'activité physique ou à des régimes alimentaires "déséquilibrés") vise donc à préserver la masse musculaire en compensant la dégradation "naturelle" des protéines par l'augmentation de la synthèse protéique. Il est important de noter qu'il suffit d'à peine 10 g d'acides aminés essentiels pour augmenter au maximum la synthèse des protéines musculaires, mais que la dégradation des protéines augmente lorsque les portions de protéines sont supérieures à 20-25 g/portion.
C'est pourquoi vous devez veiller à consommer des sources de protéines aussi "fortement dosées" que possible, qui contiennent une proportion aussi élevée que possible d'acides aminés essentiels. Il est donc peu judicieux de consommer des suppléments de protéines qui augmentent certes au maximum la synthèse des protéines par portion, mais qui stimulent aussi inutilement la dégradation des protéines en raison de la quantité totale élevée de protéines (par exemple 40 g par portion).
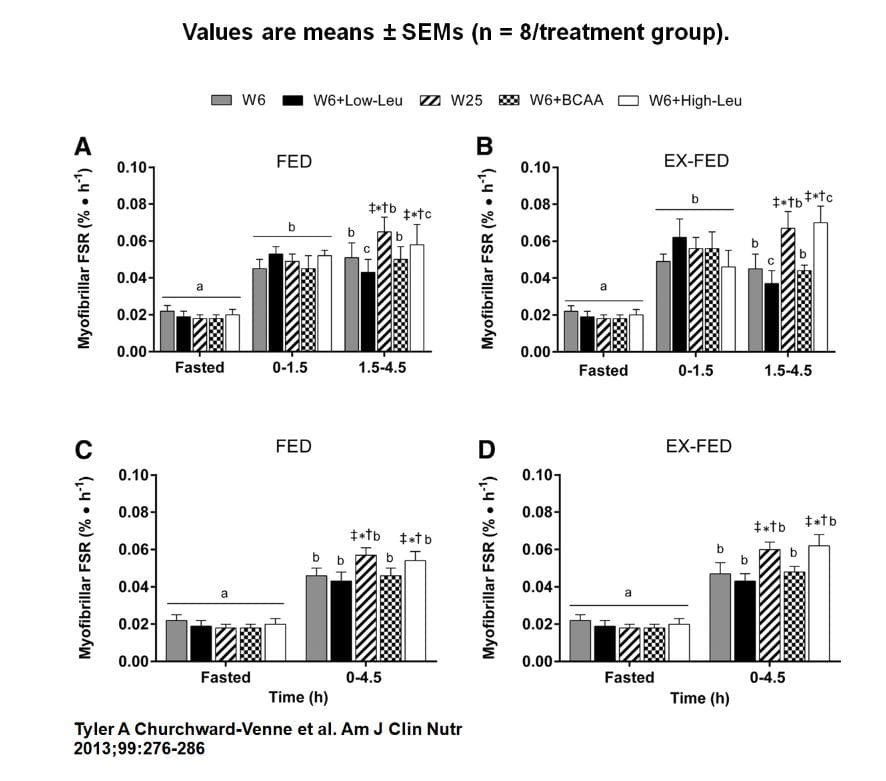
Sources de protéines vs. taux de synthèse des protéines
Dans une étude révélatrice, Tang et al. (2009) ont examiné les effets des protéines de lactosérum, des protéines de soja et de la caséine sur la vitesse de digestion (représentée par les concentrations sanguines, par exemple, des acides aminés essentiels en fonction du temps écoulé après la prise de protéines), la concentration d'insuline plasmatique et le taux mixte de synthèse des protéines musculaires. Pour ce faire, ils ont recruté 18 hommes jeunes, en bonne santé et habitués à faire de la musculation, qui, une fois reposés, ont effectué les deux exercices d'extension du genou et de presse à jambes sur une seule jambe jusqu'à l'échec musculaire ("intense") pendant trois jours différents, avec suffisamment de repos entre les deux (la jambe au repos servant de contrôle interne). Tous les participants à l'étude ont consommé, dans un ordre aléatoire, immédiatement après l'entraînement musculaire, soit des protéines de lactosérum, soit des protéines de soja, soit de la caséine, toutes les portions de protéines contenant environ 10 g d'acides aminés essentiels (AAE).
Trois heures après l'apport en protéines, les chercheurs ont prélevé un échantillon de tissu musculaire sur chacune des deux cuisses à l'aide d'aiguilles à biopsie et ont déterminé le taux de synthèse des protéines musculaires mixtes. En outre, ils ont prélevé des échantillons de sang de tous les participants à l'étude 30, 60, 90, 120 et 180 minutes après l'apport en protéines et ont analysé le sang pour déterminer la concentration des acides aminés essentiels, l'insuline L-phénylalanine et la L-leucine.
Profils d'acides aminés des boissons protéinées consommées (protéines dissoutes dans de l'eau) :
|
|
Boisson protéinée |
|
| Petit-lait |
Caséine |
Soja |
| alanine, g |
1.1 |
0.6 |
1.0 |
| Arginine, g |
0.6 |
0.8 |
1.7 |
| Acide aspartique, g |
2.2 |
1.4 |
2.6 |
| Cystine, g |
0.4 |
0.1 |
0.3 |
| Acide glutamique, g |
3.6 |
4.4 |
4.3 |
| Glycine, g |
0.4 |
0.5 |
0.9 |
| Histidine, g |
0.4 |
0.6 |
0.6 |
| Isoleucine, g |
1.4 |
1.2 |
1.1 |
| Leucine, g |
2.3 |
1.8 |
1.8 |
| Lysine, g |
1.9 |
1.6 |
1.4 |
| Méthionine, g |
0.5 |
0.5 |
0.3 |
| Phénylalanine, g |
0.7 |
1.0 |
1.2 |
| Proline, g |
1.4 |
2.2 |
1.2 |
| Sérine, g |
1.1 |
1.2 |
1.2 |
| Threonine, g |
1.0 |
0.9 |
0.8 |
| Tryptophane, g |
0.3 |
0.2 |
0.2 |
| Tyrosine, g |
0.7 |
1.2 |
0.8 |
| Valine, g |
1.0 |
1.4 |
1.1 |
| Total, g |
21.4 |
21.9 |
22.2 |
| Acides aminés essentiels, g |
10.0 |
10.1 |
10.1 |
|
|
|
|
|
Les analyses ont montré des différences claires entre les différentes sources de protéines.
Concentration sanguine ("vitesse de digestion")
Alors que la protéine de lactosérum a presque doublé la concentration d'EAS 30 minutes après sa consommation et que la protéine de soja a multiplié par près de 1,5 la concentration d'EAS dans le sang dans le même laps de temps, la caséine n'a augmenté la concentration d'EAS dans le sang que d'environ 50%. Après 3 heures, la concentration d'EAS s'est rapprochée de sa valeur initiale pour toutes les sources de protéines, tandis que la caséine a entraîné une chute moins brutale que la protéine de lactosérum et la protéine de soja. En ce qui concerne la concentration de L-leucine, la protéine de lactosérum a entraîné une augmentation de la concentration (mesurée par l'aire sous la courbe) presque trois fois plus importante que celle de la caséine et environ deux fois plus importante que celle de la protéine de soja. En ce qui concerne la concentration d'insuline dans le sang, on a constaté que la protéine de lactosérum augmentait le plus la concentration d'insuline, suivie de près par la protéine de soja. En revanche, la caséine n'a pas modifié la concentration d'insuline dans le sang.
Taux de synthèse des protéines musculaires
La prise de protéines de lactosérum et de soja a entraîné une augmentation plus importante du taux de synthèse des protéines musculaires que la caséine, aussi bien au repos (jambe non entraînée) qu'après l'entraînement. De plus, l'augmentation après l'entraînement était plus importante avec les protéines de lactosérum qu'avec le soja.
En résumé, on peut retenir les points suivants concernant les protéines
- La protéine de lactosérum, administrée après l'entraînement, entraîne une augmentation plus importante de la concentration d'acides aminés et d'insuline dans le sang que la protéine de soja et la protéine de soja que la caséine (lactosérum > soja > caséine).
- La protéine de lactosérum augmente davantage le taux de synthèse des protéines musculaires que la protéine de soja et celle-ci davantage que la caséine.
- La "vitesse de digestion" détermine en grande partie l'augmentation du taux de synthèse des protéines musculaires (plus l'augmentation est rapide et élevée, plus l'augmentation du taux de synthèse des protéines musculaires est importante).
- Lorsque la même quantité d'EAS est administrée (environ 10 g), la source de protéines la plus riche en L-leucine est celle qui augmente le plus la synthèse des protéines musculaires.
Qu'est-ce que cela signifie dans la pratique ?
Buvez environ 20 g de protéines de lactosérum après l'entraînement.
Ne consommez pas de caséine après votre entraînement musculaire. Renoncez donc aux shakes prêts à l'emploi UHT à base de lait (éventuellement massivement sucrés). Mélangez votre poudre de protéines de lactosérum avec de l'eau ou buvez une boisson à base de whey à base d'eau. La caséine est donc plus adaptée à l'apport en protéines avant le coucher.
Si vous ne pouvez ou ne voulez pas consommer de protéines de lactosérum, complétez donc votre shake de protéines de soja avec de la L-leucine ou des BCAA.